آزمون اندوتوکسین در آب های RO، DI و WFI در صنایع دارویی و پزشکی اهمیتی حیاتی دارد، زیرا این آبها بهعنوان پایه اصلی در تهیه داروهای تزریقی، محلولهای همودیالیز و فرآیندهای بیوتکنولوژی بهکار میروند و حتی مقادیر بسیار کم اندوتوکسین (لیپوپلیساکارید آزادشده از باکتریهای گرم منفی) میتواند باعث پاسخهای التهابی، تب یا شوک سپتیک در بیماران شود.
در حالیکه سیستمهای RO و DI توان حذف یونها و آلایندههای شیمیایی را دارند، کارایی آنها در حذف کامل اندوتوکسینها محدود است و همین امر ضرورت پایش دقیق این آبها را برجسته میسازد. از سوی دیگر، استانداردهای بینالمللی مانند USP <85> و Ph. Eur.
برای آب WFI سختگیرانهترین حدود مجاز اندوتوکسین (≤0.25 EU/ml) را تعیین کردهاند، زیرا این نوع آب مستقیماً در تماس با سیستم گردش خون بیماران قرار میگیرد. بنابراین انجام آزمون اندوتوکسین نهتنها معیاری برای کنترل کیفیت آبهای فرایندی است، بلکه تضمینی برای ایمنی بیمار و انطباق محصولات با الزامات نظارتی به شمار میرود.
جهت دریافت خدمات و مشاوره رایگان با نیکوفامد تماس بگیرید.
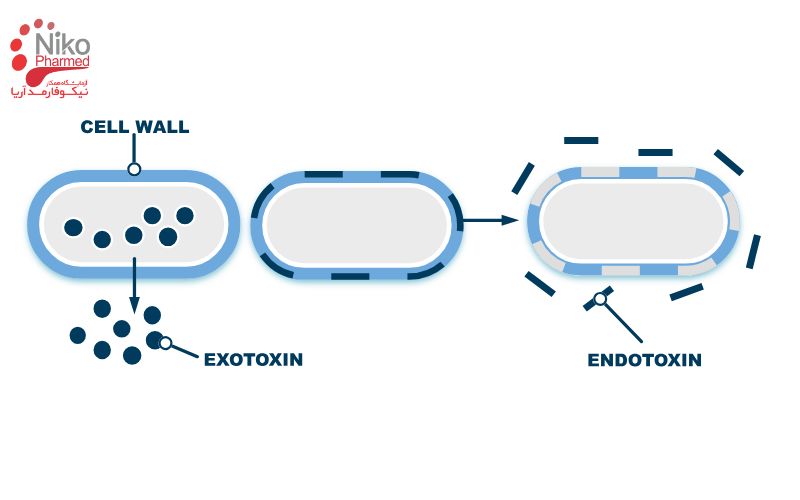
اندوتوکسین چیست؟
اندوتوکسین بخشی از غشای خارجی باکتریهای گرم منفی است که عمدتاً از ترکیب لیپوپلیساکاریدها (LPS) تشکیل شده و بخش لیپید A آن عامل اصلی سمیت و تحریک پاسخهای التهابی در بدن محسوب میشود.
این مولکول در اثر مرگ یا تجزیه باکتریها آزاد شده و به دلیل پایداری حرارتی و مقاومت در برابر بسیاری از فرآیندهای ضدعفونی، میتواند در آب و محیطهای فرایندی باقی بماند. حضور اندوتوکسین در بدن، حتی در مقادیر بسیار کم، قادر است تب، واکنشهای ایمنی شدید، التهاب سیستمیک و در موارد حاد سپسیس و شوک سپتیک ایجاد کند.
از این رو، اندوتوکسین بهعنوان یکی از مهمترین آلایندههای پنهان در حوزه داروسازی و پزشکی شناخته میشود که کنترل آن ضرورتی حیاتی دارد.
با توجه به آنکه آبهای RO (اسمز معکوس) و DI (دیونایز) هرچند در حذف یونها و ناخالصیهای شیمیایی مؤثرند، اما قادر به حذف کامل اندوتوکسین نیستند و آب WFI (آب قابل تزریق) نیز باید بالاترین سطح خلوص را دارا باشد، آزمون اندوتوکسین بر روی این آبها الزامی است.
روش استاندارد این ارزیابی، آزمون LAL (Limulus Amebocyte Lysate) است که با حساسیتی بسیار بالا و بر اساس واکنش اختصاصی با اندوتوکسین، میزان آن را در آب مشخص میسازد. این آزمون طبق الزامات بینالمللی نظیر<USP 85> و Ph. Eur. 2.6.14 مرجع قانونی محسوب شده و انجام آن تضمینکننده کیفیت و ایمنی آب در فرآیندهای دارویی، بیوتکنولوژی و پزشکی است.
تاثیر اندوتوکسین در آب های RO، WFI، DI
اندوتوکسین در آبهای فرآیندی مانند RO، DI و WFI یک تهدید پنهان اما جدی محسوب میشود، زیرا این آبها بهطور مستقیم یا غیرمستقیم در تولید داروها، فرآوردههای تزریقی و محصولات بیوتکنولوژی استفاده میشوند.
در آب RO، هرچند غشاهای اسمز معکوس بخش زیادی از باکتریها و ناخالصیها را حذف میکنند، اما اندوتوکسینها به دلیل ابعاد کوچک و پایداری بالا میتوانند تا حدی از غشا عبور کرده یا در سطح آن تجمع یابند.
در آب DI، بهعلت آنکه رزینهای تبادل یونی فقط یونها را حذف میکنند، مولکولهای اندوتوکسین بدون تغییر در آب باقی میمانند و حتی بهدلیل خاصیت خوراکی بودن رزینها برای میکروارگانیسمها، احتمال رشد باکتری و افزایش تولید اندوتوکسین بیشتر است.
در آب WFI که مستقیماً در فرآوردههای تزریقی به کار میرود، حضور اندوتوکسین خطری بسیار جدی ایجاد میکند، زیرا حتی مقادیر کمتر از 0.25 EU/ml میتواند در بیماران واکنشهای تبزا و در شرایط خاص شوک سپتیک ایجاد نماید. از این رو، کنترل مستمر اندوتوکسین در تمام مراحل تولید، ذخیرهسازی و توزیع این آبها برای تضمین ایمنی بیماران و انطباق با استانداردهای دارویی بینالمللی ضروری است.
| نوع آب | ویژگی اصلی | احتمال حضور اندوتوکسین | شدت خطر در کاربرد | توضیح تخصصی |
|---|---|---|---|---|
| RO (Reverse Osmosis) | حذف عمده یونها، نمکها و میکروارگانیسمها با غشا | متوسط؛ بهدلیل عبور بخشی از اندوتوکسین از غشا یا تجمع در سطح آن | متوسط؛ در صورت استفاده مستقیم در صنایع غیرتزریقی | غشای RO اندوتوکسین را کامل حذف نمیکند و نیاز به مراحل تکمیلی مثل UF یا EDI وجود دارد. |
| DI (Deionized Water) | حذف یونها با رزینهای تبادل یونی | زیاد؛ چون رزینها اندوتوکسین را حذف نمیکنند و محیط مناسبی برای رشد باکتری ایجاد میکنند | زیاد؛ بهخصوص در کاربردهای آزمایشگاهی حساس و بیوتکنولوژی | اندوتوکسین بهسادگی از رزین عبور میکند و در صورت آلودگی میتواند سطح بالایی از اندوتوکسین ایجاد شود. |
| WFI (Water for Injection) | خالصترین آب دارویی با تقطیر یا روشهای غشایی | خیلی کم (باید نزدیک صفر باشد)؛ طبق استاندارد ≤0.25 EU/ml | خیلی زیاد؛ زیرا مستقیماً وارد بدن بیمار میشود | کوچکترین آلودگی اندوتوکسین در WFI تهدیدی مستقیم برای ایمنی بیمار است و میتواند تب، التهاب و شوک سپتیک ایجاد کند. |
به طور خلاصه:
- بیشترین احتمال حضور اندوتوکسین در آب DI است.
- خطرناکترین تأثیر اندوتوکسین در آب WFI است، چون مستقیماً در تزریقات انسانی استفاده میشود.
- آب RO سطح میانی دارد و بیشتر بهعنوان مرحله پیشتصفیه به کار میرود.
آزمون اندوتوکسین به روش (Gel-Clot LAL Test) چگونه انجام می شود؟
آزمون اندوتوکسین روش ژل-کلات قدیمیترین و سادهترین شکل آزمون LAL است که بهصورت کیفی انجام میشود. در این روش، اندوتوکسین با فعالسازی مسیر انعقادی در آمیبوسیتهای خرچنگ نعلاسبی (Limulus polyphemus) موجب تشکیل ژل پایدار در ویال میگردد. شدت تشکیل ژل متناسب با وجود یا عدم وجود اندوتوکسین در غلظت بالاتر از حد حساسیت معرف است.
مراحل انجام آزمون
- آمادهسازی نمونه و معرفها
معرف LAL: کیت تجاری LAL با حساسیت مشخص (λ) که توسط سازنده تعیین میشود (مثلاً 0.125 EU/ml).
نمونه آزمایش: آب یا محلول مورد نظر در ظروف عاری از اندوتوکسین جمعآوری میشود.
کنترلها:
- کنترل منفی (Blank): آب بدون اندوتوکسین → نباید ژل تشکیل شود.
- کنترل مثبت (Positive Control): نمونه + مقدار مشخصی اندوتوکسین استاندارد (CSE) → باید ژل تشکیل دهد.
- کنترل محصول مثبت (PPC): برای بررسی تداخل احتمالی نمونه
- انجام واکنش
مقدار مساوی از نمونه (0.1 ml) و معرف LAL به ویال یا آمپول استریل افزوده میشود.
مخلوط بهآرامی همگن میشود تا کف ایجاد نشود.
ویالها در دمای 37 ± 1 °C برای مدت 60 ± 2 دقیقه در انکوباتور نگهداری میشوند.
پس از پایان انکوباسیون، ویالها بهآرامی وارونه (Inversion Test) میشوند:
- اگر ژل پایدار باقی بماند و محتوا حرکت نکند → آزمون مثبت (Presence of Endotoxin).
- اگر ژل پایدار نباشد و مایع روان شود → آزمون منفی.
حد مجاز و تفسیر
حد مجاز روش برابر با λ کیت مورد استفاده است (مثلاً 0.125 EU/ml).
نتیجه آزمون کیفی است (وجود یا عدم وجود اندوتوکسین بالاتر از حد حساسیت).
برای بررسی حد مجاز (limit test)، چند رقت از نمونه آزمایش میشود تا مشخص شود در چه غلظتی ژل تشکیل میشود.
جهت آشنایی با آزمون استریلیتی کلیک کنید.
آزمایشگاه همکار نیکوفارمد با بهرهمندی از تجهیزات پیشرفته و کارشناسان متخصص در حوزه میکروبیولوژی، آزمون اندوتوکسین آب را مطابق با الزامات بینالمللی از جمله <USP 85> و Ph. Eur. انجام میدهد.آزمون اندوتوکسین در آب که با روشLAL (ژل-کلات) اجرا میشود، امکان شناسایی حتی مقادیر بسیار ناچیز اندوتوکسین را فراهم کرده و به تولیدکنندگان اطمینان میدهد که آب مورد استفاده در فرآیندهای دارویی، بیوتکنولوژی و پزشکی از نظر ایمنی و انطباق با استانداردهای نظارتی در بالاترین سطح کنترل شده است. انتخاب نیکوفارمد بهعنوان مرجع آزمون اندوتوکسین، تضمینی برای کیفیت، اعتبار و ایمنی محصولات نهایی شما خواهد بود.